La eritropoyetina es una hormona glicoproteica de gran importancia para la formación de glóbulos rojos durante la generación de sangre (llamada hematopoyesis).
La palabra deriva del griego erythros “rojo” y poiein “hacer”, y también se la suele llamar EPO, epoetina y antiguamente hematopoyetina. La EPO está entre los Agentes Estimulantes de la Eritropoyesis.


La eritropoyetina pertenece filogenéticamente a la familia de las citoquinas. La eritropoyetina actúa cuando se une a un receptor celular específico (EpoR).


En los seres humanos, es producida principalmente por el riñón (90%), el resto en el hígado, aunque también —sobre todo en fetos— en cerebro y útero.


La producción de eritropoyetina es estimulada por la reducción de tensión de oxígeno en los tejidos (hipoxia tisular) sensada por las células instersticiales peritubulares. Se supone la existencia de un sensor extrarrenal. La noradrenalina, la adrenalina y varias prostaglandinas estimulan la producción de EPO. La eritropoyetina producida en el riñón estimula a las células madre de la médula ósea para que aumenten la producción de eritrocitos.


El gen de la EPO en el hombre se encuentra en el cromosoma 7 (posición 7q21-7q22). La síntesis es estimulada por la saturación de oxígeno (hipoxia) en la sangre.

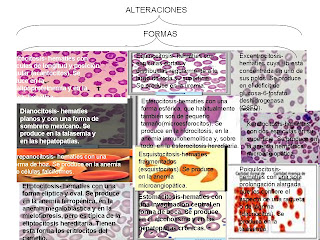
La concentración de la hormona en el suero de un hombre sano es de hasta 19 mU/mL. En la eritropoyesis, la EPO se enlaza en la médula al receptor de la eritropoyetina en las células del precursor tipo BFU-E (Unidad Formadora de Colonias Explosivas Eritroides), primero a las células más maduras del tipo CFU-E (Unidad Formadora de Colonias Eritroides), y finalmente a los eritrocitos diferenciados.


Cada día se generan aproximadamente doscientos mil millones de eritrocitos. Además de en la eritropoyesis, la EPO actúa en la diferenciación de las células de precursor y también estimula en pequeña medida la formación de megacariocitos.

La función de la EPO en el organismo no es sólo la formación de nuevos eritrocitos. El receptor de la EPO se ha encontrado en diferentes tipos de células somáticas como las neuronas, los astrocitos, células de la microglía y las células del músculo del corazón.


Los que carecen de eritropoyetina tienen debilidad muscular, ya que si el riñón no tiene esta sustancia, la resistencia al ejercicio físico disminuye notablemente. Otros problemas frecuentes son la hipertensión, el cansancio o la aparición de anemia, provocados por la debilidad muscular.



El uso de la EPO como droga de dopaje en el deporte está prohibido. El efecto "positivo" de la EPO se debe a que aumenta la masa eritrocitaria (elevando el hematocrito), lo que permite un mejor rendimiento del deportista en actividades aeróbicas. De esta forma se aumenta la resistencia al ejercicio físico.


El principal efecto adverso que produce es un incremento del riesgo de complicaciones cardiovasculares si se usa para elevar los niveles de hemoglobina por encima de 13 gramos por decilitro de sangre.